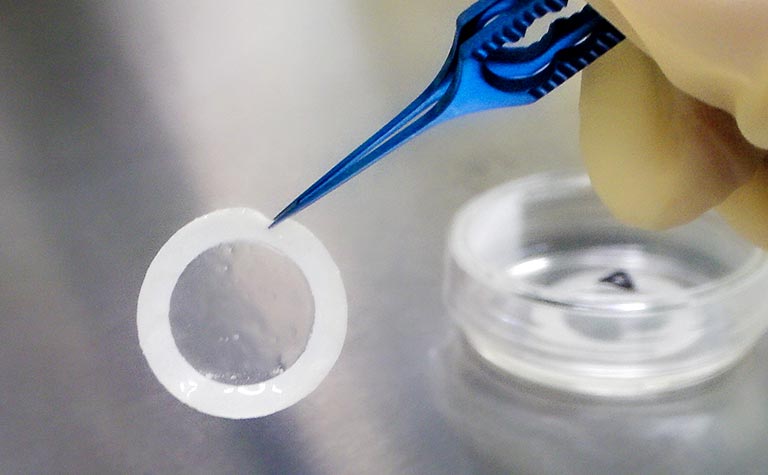
再生医療とは
医薬品の歴史と再生医療
-
-
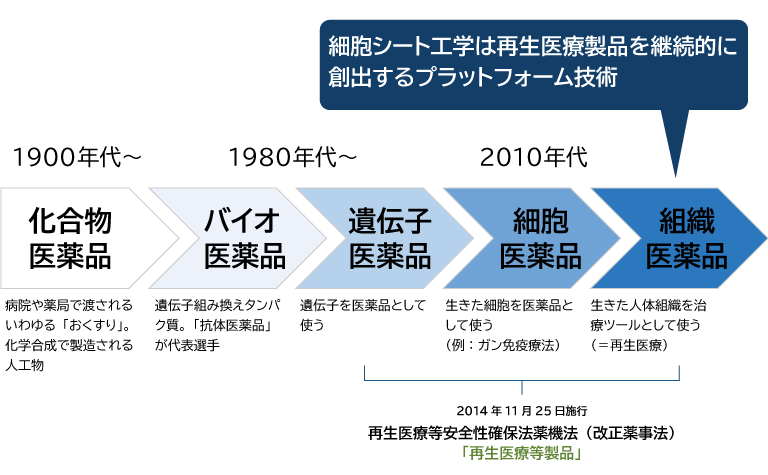
現在私たちが服用している薬の大半は化学物質で作られています。
科学の進展に伴い薬の形態も変化し、1980年代には特に大きな変化がありました。遺伝子を切り出し他へ移すといった遺伝子組み換えの技術で、ヒトの遺伝子を大腸菌などに作らせたタンパク質が薬になりました。その後、遺伝子そのものを薬にする研究も進められ、さらには細胞や組織を「薬」として投与する試みも進んでいます。これを「再生医療等製品」と呼んでいます。
日本政府もこれらの取り組みを促進すべく、2014年に既存の薬事法を改正した「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)」と「再生医療等の安全性の確保等に関する法律(安確法)」が制定されました。これにより、細胞や遺伝子を用いた新しい「薬」の開発が促進されるようになりました。
一般的な新薬の開発過程
-
-
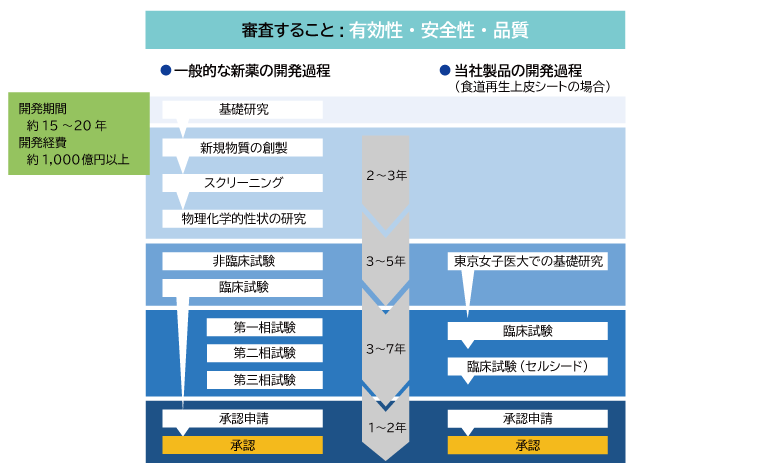
一般的な新薬を開発するには、まず対象となる病気のメカニズムを調べ、その症状を治す効果のあると予想される化学物質を多数合成し、その中から候補となる化学物質を選ぶスクリーニングが行われます。化学物質の候補を絞り込んだら、動物や細胞を用いて効果、安全性を調べます。効果や安全性が確認されたら、まず健康な人を対象に安全性を確認する臨床試験(第1相試験)を行い、次に症状のある人に投与して有効性を確認する臨床試験(第2相試験)を行います。最後に患者さんと健常人を対象とした大規模な臨床試験(第3相試験)を行います。第3相試験では投与される人も投与する人も新薬か偽薬かを知らずに実施する二重盲検試験という方法が取られることが多いです。これらすべてのデータをまとめて各国の規制当局に承認申請をし、承認が得られて初めて製品として使用できるようになります。審査するポイントは、有効性、安全性、品質の3つです。新薬の開発から医療現場に届くまでには、15年から20年ほど時間を要し、開発費用は年々増加し1,000億円またはそれ以上掛かっています。
再生医療等安全性確保法(安確法)と医薬品医療機器等法(薬機法)
-
-
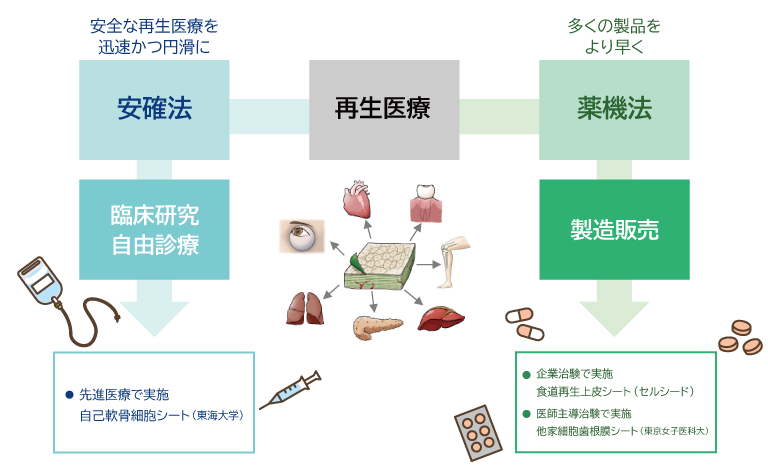
再生医療は2つの法律の下で行われています。
再生医療等安全性確保法(安確法)
医師の責任の下で実施される再生医療等を規制する法律です。
大学で実施される臨床研究や先進医療などが対象となります。この新しい法律の下では治療に用いる細胞は品質保証システムと製造能力を持つことが認められた施設であれば受託製造も可能となりました。当社の細胞培養センターは特定細胞加工施設の承認を取得し、東海大学で実施されている先進医療Bで用いられる「自己軟骨細胞シート」の受託製造を行っています。医薬品医療機器等法(薬機法)
企業が製品として承認を取る場合には、医薬品医療機器等法の下で製造・販売・承認が行われます。
当社が現在早期事業化を目指している「同種軟骨細胞シート」はこの法律の下で行っています。
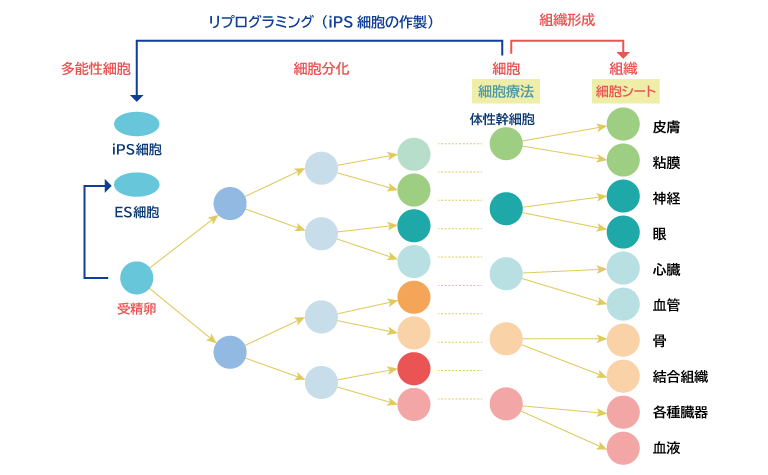
細胞シートとiPS細胞の関係
-
-
私たちの体の最小単位は細胞で、一人ひとりの体は数十兆個の細胞からできています。その細胞は皮膚や、神経細胞、心臓など見た目や形、機能が異なる細胞から構成されています。最初はたった1つの細胞から始まりそれが1つ、2つ、4つ・・・と増えていき、形や機能が分かれていきます。同じ遺伝子を持つ細胞が増えながら、その形や機能を変えていくことを細胞の分化といいます。これまでは受精卵が分化することは一方向のみの反応と考えられていましたが、京都大学の山中教授は、すでに分化した皮膚細胞に4つの遺伝子を後から加えることで、受精卵と同じように様々な機能や形に分化できる多能性細胞を作り出すことに成功しました。山中教授はこの細胞をiPS細胞と名付けました。山中教授はこの研究で2014年にノーベル医学生理学賞を受賞しました。同じ遺伝子を持つ細胞が形も機能も異なる様々な細胞に分化する複雑な仕組みについてはまだ研究中です。
当社は、iPS細胞ではなく、体性幹細胞という体の中にあり、まだ分化できる能力を持つ細胞をシート化する研究と開発を行っています。iPS細胞が目的の細胞に分化するプロセスは非常に複雑でまだ研究途上のため、当社ではより早く実用化するために体性幹細胞や分化した細胞を用いています。細胞シートは細胞同士がお互いに接着し、体の中にある細胞と似たような状態で増殖し、細胞本来の機能を発揮できる状態で移植できるというメリットがあります。
日本で承認されている再生医療等製品
日本では、2025年4月時点で20品目の再生医療等製品が承認されており、6品目が組織移植、5品目が細胞移植、5品目がex-vivo遺伝子治療、3品目がin vivo遺伝子治療、1品目がin vivoウイルス治療です。
| 企業名 | 商品名 | 対象疾患 | 上市 | |
|---|---|---|---|---|
| 組織移植 | J-TEC | ジェイス | 重症熱傷 先天性巨大色素性母斑 表皮水疱症 |
2007 2016 2018 |
| J-TEC | ジャック | 膝関節の外傷性軟骨欠損症/離断性骨軟骨炎 二次性変形性膝関節症 |
2012 2025 |
|
| J-TEC | ネピック | 角膜上皮幹細胞疲弊症 | 2020 | |
| J-TEC | オキュラル | 角膜上皮幹細胞疲弊症 | 2021 | |
| ひろさきLI | サクラシー | 角膜上皮幹細胞疲弊症 | 2022 | |
| J-TEC | ジャスミン | 尋常性白斑 | 2023 | |
| 細胞移植 | JCRファーマ | テムセルHS注 | 造血幹細胞移植後の急性GvHD | 2015 |
| ニプロ | ステミラック注 | 脊髄損傷に伴う神経症候/機能障害 | 2018 | |
| 武田薬品 | アロフィセル注 | 非活動期又は軽症の活動期クローン病患者における複雑痔瘻 | 2021 | |
| オーリオンバイオテック | ビズノバ | 水疱性角膜症 | 2023 | |
| サンバイオ | アクーゴ | 外傷性脊髄脳損傷 | 2024 | |
| ex vivo 遺伝子治療 (CAR-T) |
ノバルティス | キムリア点滴静注 | 再発又は難治性B細胞急性リンパ芽球性白血病/びまん性大細胞型B細胞リンパ腫 再発又は難治性濾胞性リンパ腫 |
2019 2022 |
| 第一三共 | イエスカルタ点滴静注 | 自家造血幹細胞移植に適応のある場合は、2レジメン以上の治療歴、適応のない場合には、1レジメン以上の治療歴のある再発又は難治性大細胞型B細胞リンパ腫 自家造血幹細胞移植に適応のある1レジメ ンの治療歴のある再発又は難治性大細胞型B細胞リンパ腫 |
2021 2022 |
|
| ブリストル・マイヤーズスクイブ | ブレヤンジ静注 | 2レジメン以上の治療歴のある再発又は難治性大細胞型B細胞リンパ腫/濾胞性リンパ腫 1レジメンの治療歴のある再発又は難治性大細胞型B細胞リンパ腫/濾胞性リンパ腫 |
2021 2022 |
|
| ブリストル・マイヤーズスクイブ | アベクマ点滴静注 | 再発又は難治性多発性骨髄腫 | 2022 | |
| ヤンセンファーマ | カービクティ点滴静注 | 再発又は難治性多発性骨髄腫 | 2022 | |
| in vivo 遺伝子治療 |
ノバルティス | ゾルゲンスマ点滴静注 | 脊髄性筋萎縮症 | 2020 |
| ノバルティス | ルクスターナ注 | 遺伝性網膜ジストロフィー | 2023 | |
| 中外製薬 | エレビジス | デュシェンヌ型筋ジストロフィー | 2025 | |
| in vivo ウイルス治療 |
第一三共 | デリタクト注 | 悪性神経膠腫 | 2021 |
よくあるご質問
細胞シートなど当社事業に関するよくあるご質問と回答をご覧いただけます。